Teoría cinética
Principios
Los principios fundamentales de la teoría cinética son los siguientes:
- Los gases están compuestos de moléculas en movimiento aleatorio. Las moléculas sufren colisiones aleatorias entre ellas y las paredes del recipiente contenedor del gas.
- Las colisiones entre las moléculas del gas y las paredes del recipiente contenedor son elásticas.
Adicionalmente, si el gas está en el interior de un recipiente, las colisiones con sus paredes se asume que son instantáneas y perfectamente elásticas.
- Están en constante movimiento, chocando entre ellas y contra las paredes del recipiente que lo contiene.
Estos postulados describen el comportamiento de un gas ideal. Los gases reales se aproximan a este comportamiento ideal en condiciones de baja densidad y temperatura.
Presión
En el marco de la teoría cinética la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas.
En efecto, para un gas ideal con N moléculas, cada una de masa m y moviéndose con una velocidad aleatoria promedio vrms contenido en un volumen cúbico V las partículas del gas impactan con las paredes del recipiente de una manera que puede calcularse de manera estadística intercambiando momento lineal con las paredes en cada choque y efectuando una fuerza neta por unidad de área que es la presión ejercida por el gas sobre la superficie sólida.
La presión puede calcularse como
Este resultado es interesante y significativo no sólo por ofrecer una forma de calcular la presión de un gas sino porque relaciona una variable macroscópica observable, la presión, con la energía cinética traslacional promedio por molécula, 1/2 mvrms², que es una magnitud microscópica no observable directamente. Nótese que el producto de la presión por el volumen del recipiente es dos tercios de la energía cinética total de las moléculas de gas contenidas.
Temperatura
La ecuación superior nos dice que la presión de un gas depende directamente de la energía cinética molecular. La ley de los gases ideales nos permite asegurar que la presión es proporcional a la temperatura absoluta. Estos dos enunciados permiten realizar una de las afirmaciones más importantes de la teoría cinética: La energía molecular promedio es proporcional a la temperatura. La constante de proporcionales es 3/2 la constante de Boltzmann, que a su vez es el cociente entre la constante de los gases R entre el número de Avogadro. Este resultado permite deducir el principio o teorema de equipartición de la energía.
La energía cinética por Kelvin es:
- Por mol 12.47 J
- Por molécula 20.7 yJ = 129 μeV
En condiciones estándar de presión y temperatura (273.15 K) se obtiene que la energía cinética total del gas es:
- Por mol 3406 J
- Por molécula 5.65 zJ = 35.2 meV
Ejemplos:
- Dihidrógeno (peso molecular = 2): 1703 kJ/kg
- Dinitrógeno (peso molecular = 28): 122 kJ/kg
- Dioxígeno (peso molecular = 32): 106 kJ/kg
Velocidad promedio de las moléculas
De las fórmulas para la energía cinética y la temperatura se tiene
donde v se mide en m/s yT en grados Kelvin.
Para una temperatura estándar la velocidad promedio de las moléculas de gas son:
Las velocidades más probables son un 81.6% de estos valores.
Ley de los gases ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
La ecuación de estado
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
Donde:
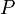 = Presión
= Presión = Volumen
= Volumen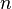 = Moles de Gas.
= Moles de Gas.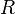 = Constante universal de los gases ideales .
= Constante universal de los gases ideales .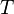 = Temperatura absoluta
= Temperatura absoluta
Ecuación general de los gases ideales
Partiendo de la ecuación de estado:
Tenemos que:
Donde R es la constante universal de los gases ideales, luego para dos estados del mismo gas, 1 y 2:
Para una misma masa gaseosa (por tanto, el número de moles «n» es constante), podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.
http://es.wikipedia.org/wiki/Ley_de_los_gases_ideales
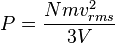
 = 24,940 T / peso molecular
= 24,940 T / peso molecular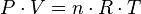
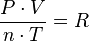


y la definicion
ResponderEliminar